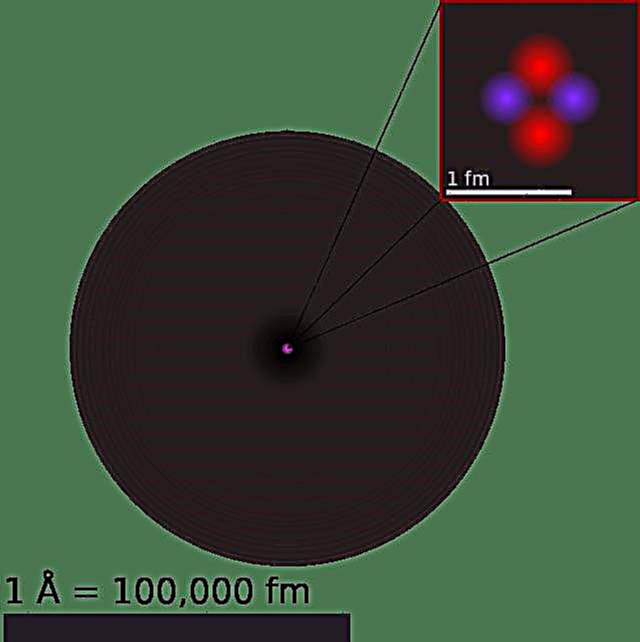
Lý thuyết nguyên tử đã đi một chặng đường dài trong vài nghìn năm qua. Bắt đầu từ thế kỷ thứ 5 trước Công nguyên với lý thuyết về thể xác không thể phân chia của Democritus, tương tác với nhau một cách máy móc, sau đó chuyển sang mô hình nguyên tử của Dalton vào thế kỷ 18, và sau đó trưởng thành vào thế kỷ 20 với việc phát hiện ra các hạt hạ nguyên tử và lý thuyết lượng tử, hành trình khám phá đã dài và quanh co.
Có thể cho rằng, một trong những cột mốc quan trọng nhất trên đường đi là mô hình nguyên tử Bohr, đôi khi được gọi là mô hình nguyên tử Rutherford-Bohr. Được đề xuất bởi nhà vật lý người Đan Mạch Niels Bohr vào năm 1913, mô hình này mô tả nguyên tử là một hạt nhân nhỏ, tích điện dương được bao quanh bởi các electron di chuyển trên quỹ đạo tròn (được xác định bởi mức năng lượng của chúng) quanh tâm.
Lý thuyết nguyên tử đến thế kỷ 19:
Những ví dụ sớm nhất được biết đến của lý thuyết nguyên tử đến từ Hy Lạp và Ấn Độ cổ đại, nơi các nhà triết học như Democritus cho rằng tất cả vật chất đều bao gồm các đơn vị nhỏ bé, không thể chia cắt và không thể phá hủy. Thuật ngữ Nguyên tử nghiêm khắc được đặt ra ở Hy Lạp cổ đại và đã phát sinh trường phái tư tưởng được gọi là chủ nghĩa nguyên tử Hồi giáo. Tuy nhiên, lý thuyết này là một khái niệm triết học hơn là một khoa học.
Mãi đến thế kỷ 19, lý thuyết nguyên tử mới được đưa ra như một vấn đề khoa học, với những thí nghiệm dựa trên bằng chứng đầu tiên được tiến hành. Ví dụ, vào đầu năm 1800, nhà khoa học người Anh John Dalton đã sử dụng khái niệm nguyên tử để giải thích tại sao các nguyên tố hóa học phản ứng theo những cách có thể quan sát và dự đoán được. Thông qua một loạt các thí nghiệm liên quan đến khí, Dalton tiếp tục phát triển cái gọi là Lý thuyết nguyên tử Dalton.
Lý thuyết này mở rộng dựa trên các định luật về khối lượng và tỷ lệ xác định và đi xuống năm tiền đề: các nguyên tố, ở trạng thái tinh khiết nhất của chúng, bao gồm các hạt gọi là nguyên tử; các nguyên tử của một nguyên tố cụ thể đều giống nhau, cho đến tận nguyên tử cuối cùng; các nguyên tử của các nguyên tố khác nhau có thể được phân biệt bằng trọng lượng nguyên tử của chúng; nguyên tử của các nguyên tố hợp nhất để tạo thành các hợp chất hóa học; các nguyên tử không thể được tạo ra hoặc phá hủy trong phản ứng hóa học, chỉ có nhóm được thay đổi.
Khám phá về điện tử:
Đến cuối thế kỷ 19, các nhà khoa học cũng bắt đầu đưa ra giả thuyết rằng nguyên tử được tạo thành từ nhiều hơn một đơn vị cơ bản. Tuy nhiên, hầu hết các nhà khoa học đều mạo hiểm rằng đơn vị này sẽ có kích thước của nguyên tử nhỏ nhất được biết đến - hydro. Vào cuối thế kỷ 19, điều này sẽ thay đổi mạnh mẽ, nhờ vào nghiên cứu được thực hiện bởi các nhà khoa học như Ngài Joseph John Thomson.
Thông qua một loạt các thí nghiệm sử dụng ống tia catốt (được gọi là ống Crookes), Thomson quan sát thấy rằng tia catốt có thể bị lệch bởi điện trường và từ trường. Ông kết luận rằng thay vì được cấu tạo từ ánh sáng, chúng được tạo thành từ các hạt tích điện âm nhỏ hơn 1 lần và nhẹ hơn 1800 lần so với hydro.

Điều này đã bác bỏ một cách hiệu quả quan niệm rằng nguyên tử hydro là đơn vị vật chất nhỏ nhất, và Thompson đã đi xa hơn để cho rằng các nguyên tử là số chia hết. Để giải thích điện tích tổng thể của nguyên tử, bao gồm cả điện tích dương và điện tích âm, Thompson đã đề xuất một mô hình theo đó các khối tích điện âm được phân phối trong một biển tích điện dương - được gọi là Mô hình Plum Pudding.
Các tiểu thể này sau đó sẽ được đặt tên là các electron electron, dựa trên hạt lý thuyết được dự đoán bởi nhà vật lý người Anh-Ailen George Johnstone Stoney vào năm 1874. Và từ đó, Mô hình Plum Pudding ra đời, được đặt tên như vậy vì nó gần giống với sa mạc Anh bao gồm bánh mận và nho khô. Khái niệm này đã được giới thiệu với thế giới trong phiên bản tháng 3 năm 1904 của Vương quốc Anh Tạp chí triết học, để hoan nghênh rộng rãi.
Mô hình Rutherford:
Các thí nghiệm sau đó đã tiết lộ một số vấn đề khoa học với mô hình Plum Pudding. Để bắt đầu, đã có vấn đề chứng minh rằng nguyên tử sở hữu điện tích dương đồng nhất, được gọi là Vấn đề Thom Thomson. Năm năm sau, mô hình sẽ bị từ chối bởi Hans Geiger và Ernest Marsden, người đã thực hiện một loạt các thí nghiệm sử dụng các hạt alpha và lá vàng - aka. thí nghiệm lá vàng.
Trong thí nghiệm này, Geiger và Marsden đã đo mô hình tán xạ của các hạt alpha bằng màn hình huỳnh quang. Nếu mô hình Thomson nhiệt là chính xác, các hạt alpha sẽ đi qua cấu trúc nguyên tử của lá không bị cản trở. Tuy nhiên, thay vào đó, họ lưu ý rằng trong khi hầu hết bắn thẳng qua, một số trong số chúng bị phân tán theo nhiều hướng khác nhau, một số quay trở lại theo hướng của nguồn.

Geiger và Marsden kết luận rằng các hạt đã gặp phải lực tĩnh điện lớn hơn nhiều so với mức cho phép của mô hình Thomson Lần. Vì các hạt alpha chỉ là hạt nhân helium (được tích điện dương), điều này ngụ ý rằng điện tích dương trong nguyên tử không bị phân tán rộng rãi mà tập trung thành một thể tích nhỏ. Ngoài ra, việc những hạt không bị lệch đi qua không bị cản trở có nghĩa là những không gian tích cực này bị ngăn cách bởi những khoảng trống rộng lớn của không gian trống.
Đến năm 1911, nhà vật lý Ernest Rutherford đã giải thích các thí nghiệm Geiger-Marsden và từ chối mô hình nguyên tử Thomson. Thay vào đó, ông đề xuất một mô hình trong đó nguyên tử bao gồm hầu hết không gian trống, với toàn bộ điện tích dương tập trung ở trung tâm của nó trong một thể tích rất nhỏ, được bao quanh bởi một đám mây điện tử. Điều này được biết đến như là Mô hình nguyên tử Rutherford.
Mô hình Bohr:
Các thí nghiệm tiếp theo của Antonius Van den Broek và Niels Bohr đã cải tiến mô hình hơn nữa. Trong khi Van den Broek cho rằng số nguyên tử của một nguyên tố rất giống với điện tích hạt nhân của nó, thì sau đó đã đề xuất một mô hình giống như Hệ mặt trời của nguyên tử, trong đó một hạt nhân chứa số nguyên tử mang điện tích dương và được bao quanh bằng một số lượng electron trong vỏ quỹ đạo (hay còn gọi là Mô hình Bohr).
Ngoài ra, mô hình Bohriên đã tinh chỉnh một số yếu tố của mô hình Rutherford có vấn đề. Chúng bao gồm các vấn đề phát sinh từ cơ học cổ điển, dự đoán rằng các electron sẽ giải phóng bức xạ điện từ trong khi quay quanh hạt nhân. Do mất năng lượng, nên electron đã nhanh chóng xoắn vào bên trong và sụp đổ vào hạt nhân. Nói tóm lại, mô hình nguyên tử này ngụ ý rằng tất cả các nguyên tử đều không ổn định.

Mô hình cũng dự đoán rằng khi các electron xoắn ốc vào bên trong, sự phát xạ của chúng sẽ tăng nhanh về tần số khi quỹ đạo nhỏ hơn và nhanh hơn. Tuy nhiên, các thí nghiệm phóng điện vào cuối thế kỷ 19 cho thấy các nguyên tử chỉ phát ra năng lượng điện từ ở một số tần số riêng biệt.
Bohr đã giải quyết điều này bằng cách đề xuất rằng các electron quay quanh hạt nhân theo những cách phù hợp với thuyết bức xạ lượng tử Planckùi. Trong mô hình này, các electron chỉ có thể chiếm một số quỹ đạo nhất định được phép với một năng lượng cụ thể. Hơn nữa, họ chỉ có thể tăng và giảm năng lượng bằng cách nhảy từ quỹ đạo được phép này sang quỹ đạo khác, hấp thụ hoặc phát ra bức xạ điện từ trong quá trình.
Những quỹ đạo này được liên kết với những năng lượng xác định, mà ông gọi là vỏ năng lượng hoặc là mức năng lượng. Nói cách khác, năng lượng của một electron bên trong một nguyên tử không phải là liên tục, mà là lượng tử hóa. Các mức này do đó được dán nhãn bằng số lượng tử n (n = 1, 2, 3, v.v.) mà ông tuyên bố có thể được xác định bằng cách sử dụng công thức Ryberg - một quy tắc được xây dựng vào năm 1888 bởi nhà vật lý người Thụy Điển, ông Julian Ryberg để mô tả bước sóng của các vạch quang phổ của nhiều nguyên tố hóa học.
Ảnh hưởng của mô hình Bohr:
Trong khi mô hình Bohriên đã chứng minh được sự đột phá ở một số khía cạnh - hợp nhất hằng số Ryberg Lâu và hằng số Planckiến (hay còn gọi là lý thuyết lượng tử) với Mô hình Rutherford - nó đã bị một số sai sót mà các thí nghiệm sau này sẽ minh họa. Để bắt đầu, người ta cho rằng các electron có cả bán kính và quỹ đạo đã biết, một cái gì đó mà Werner Heisenberg sẽ từ chối một thập kỷ sau với Nguyên lý bất định của mình.
Ngoài ra, mặc dù rất hữu ích trong việc dự đoán hành vi của các electron trong nguyên tử hydro, nhưng mô hình Bohr không đặc biệt hữu ích trong việc dự đoán phổ của các nguyên tử lớn hơn. Trong những trường hợp này, nơi các nguyên tử có nhiều electron, mức năng lượng không phù hợp với những gì Bohr dự đoán. Mô hình này cũng không hoạt động với các nguyên tử helium trung tính.
Mô hình Bohr cũng không thể giải thích được Hiệu ứng Zeeman, một hiện tượng được ghi nhận bởi các nhà vật lý người Hà Lan, ông Pieter Zeeman vào năm 1902, trong đó các vạch quang phổ được chia thành hai hoặc nhiều hơn khi có từ trường tĩnh, bên ngoài. Bởi vì điều này, một số tinh chỉnh đã được thử với mô hình nguyên tử Bohr, nhưng những điều này cũng được chứng minh là có vấn đề.
Cuối cùng, điều này sẽ dẫn đến mô hình Bohriên bị thay thế bởi lý thuyết lượng tử - phù hợp với công việc của Heisenberg và Erwin Schrodinger. Tuy nhiên, mô hình Bohriên vẫn hữu ích như một công cụ hướng dẫn để giới thiệu cho sinh viên về các lý thuyết hiện đại hơn - như cơ học lượng tử và mô hình nguyên tử vỏ hóa trị.
Nó cũng sẽ chứng tỏ là một cột mốc quan trọng trong sự phát triển của Mô hình chuẩn của vật lý hạt, một mô hình đặc trưng bởi các đám mây electron điện tử, các hạt cơ bản và độ không đảm bảo.
Chúng tôi đã viết nhiều bài viết thú vị về lý thuyết nguyên tử ở đây tại Tạp chí Vũ trụ. Ở đây Mô hình nguyên tử của John Johntonton, Mô hình bánh mận là gì, Mô hình đám mây điện tử là gì?, Ai là Democritus?, Và các bộ phận của nguyên tử là gì?
Cast Astronomy Cast cũng có một số tập về chủ đề: Tập 138: Cơ học lượng tử, Tập 139: Mức năng lượng và quang phổ, Tập 378: Rutherford và các nguyên tử và Tập 392: Mô hình chuẩn - Giới thiệu.
Nguồn:
- Niels Bohr (1913) về Hiến pháp của các nguyên tử và phân tử, Phần I
- Niels Bohr (1913) về Hiến pháp của các nguyên tử và phân tử, Hệ thống phần II chỉ chứa một hạt nhân duy nhất
- Bách khoa toàn thư Britannica: Mô hình nguyên tử Borh
- Siêu âm - Mô hình Bohr
- Đại học Tennessee, Knoxville - Mô hình Borh
- Đại học Toronto - Mô hình Bohr của nguyên tử
- NASA - Tưởng tượng vũ trụ - Bối cảnh: Nguyên tử và Năng lượng ánh sáng
- Về giáo dục - Mô hình Bohr của nguyên tử